
技术文章
Technical articles 更新时间:2025-12-05
更新时间:2025-12-05 点击次数:289
点击次数:289

坏死性凋亡(Necroptosis)是一种程序性细胞死亡方式,由RIPK3激酶磷酸化MLKL蛋白后引发,导致细胞膜破裂并释放损伤相关分子模式(DAMPs),从而引发炎症反应。传统观点认为,MLKL主要作用于细胞膜,诱导其破裂。然而,近年研究发现MLKL也可定位于线粒体,但其功能尚不明确。此外,线粒体DNA(mtDNA)在细胞应激状态下可释放至胞质,激活cGAS-STING通路,诱导I型干扰素表达。本研究旨在探讨MLKL是否通过介导mtDNA释放,激活cGAS-STING通路,从而在坏死性凋亡中发挥促炎作用。
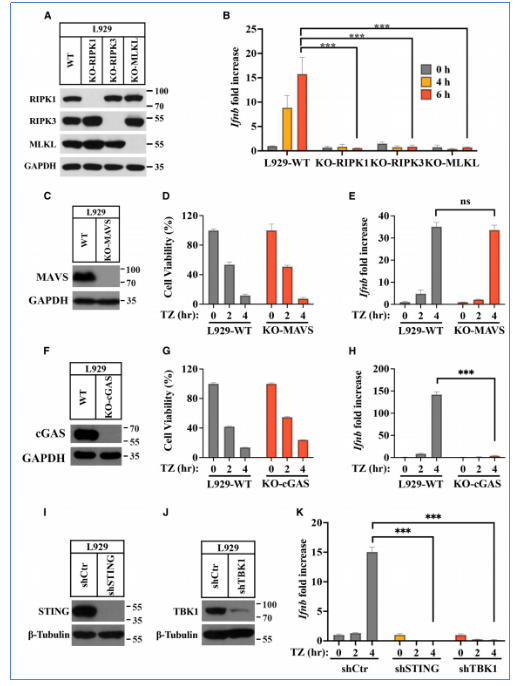
研究发现,在L929细胞系中,诱导坏死性凋亡(如,使用TNF-α+Z-VAD-FMK)可显著上调IFN-β(干扰素β)及其刺激基因(ISGs)的表达。该表达依赖于RIPK1、RIPK3和MLKL的完整性,且可被cGAS、STING或TBK1的敲除或抑制所阻断,表明坏死性凋亡通过cGAS-STING通路诱导I型干扰素表达。
研究发现坏死性凋亡诱导后,mtDNA显著富集于胞质中,而核DNA无明显变化。该现象在多种细胞系中均可观察到,且依赖于MLKL的存在。mtDNA释放不伴随其总量增加,提示其来源于线粒体的泄漏而非复制增强。
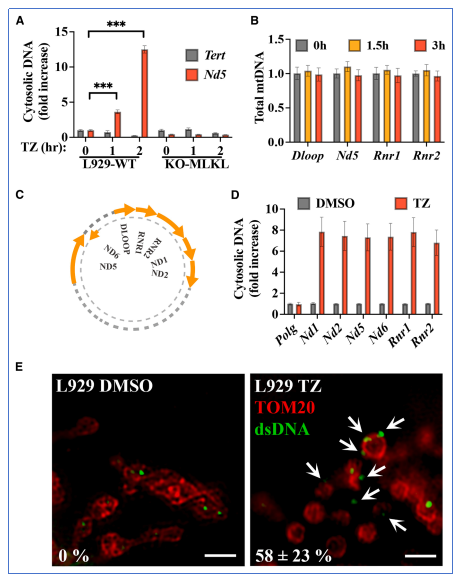
通过使用mtDNA复制抑制剂(如ddC)构建mtDNA缺失细胞,研究发现即使细胞仍能发生坏死性凋亡,IFN-β的表达几乎被抑制。这证实mtDNA是激活cGAS-STING通路、诱导干扰素表达的关键胞质DNA来源。

研究排除了多种已知的mtDNA释放机制,如线粒体通透性转换孔(mPTP)、电压依赖性阴离子通道(VDAC)、Bax/Bak孔道等在坏死性凋亡中的作用。相关抑制剂或基因敲除均未影响mtDNA释放,提示其机制与凋亡或焦亡不同。

通过免疫荧光、电镜和线粒体分离实验,研究证实磷酸化MLKL可定位于线粒体外膜和内膜,诱导膜结构破坏并形成孔道,进而介导mtDNA释放。MLKL与心磷脂结合是其定位于线粒体的关键,PLSCR3(心磷脂转运蛋白)缺失可显著减少mtDNA释放和IFN-β表达。

研究发现,微管破坏剂(如秋水仙素Colchicine、小分子D-64131、长春新碱 Vincristine)可显著抑制mtDNA释放,而微管稳定剂无此效应。尽管微管破坏不影响MLKL向线粒体的转位,但可能通过影响mtDNA与线粒体膜或MLKL孔道的相互作用,阻碍其释放。

在Caspase-8缺失诱导的小鼠肠炎模型中,研究发现肠上皮细胞中磷酸化MLKL显著上调,mtDNA释放增加,IFN-β表达升高。使用STING抑制剂H-151可显著减轻炎症反应、减少干扰素表达和中性粒细胞浸润,提示该通路在坏死性凋亡相关炎症性疾病中具有重要作用。

本研究系统阐明了坏死性凋亡过程中,磷酸化MLKL不仅破坏细胞膜,还可定位于线粒体,诱导mtDNA释放至胞质,激活cGAS-STING通路,从而以细胞自主方式诱导干扰素表达和炎症反应。该机制不依赖传统孔道形成蛋白(如mPTP等),且需要微管结构完整性。该发现为理解坏死性凋亡在炎症性疾病中的作用提供了新机制,并为相关疾病(如炎症性肠病)的治疗提供了潜在靶点。

Ding Z, Wang R, Li Y, Wang X. MLKL activates the cGAS-STING pathway by releasing mitochondrial DNA upon necroptosis induction. Mol Cell. 2025 Jul 3;85(13):2610-2625.e5. doi: 10.1016/j.molcel.2025.06.005. PMID: 40614706.