
技术文章
Technical articles 更新时间:2025-11-28
更新时间:2025-11-28 点击次数:255
点击次数:255
结直肠癌肝转移的困境
结直肠癌肝转移是结直肠癌zui常见的远处转移形式,约15%-25%患者在初诊时即合并肝转移,约50%患者病程中发生肝转移,其中约20%为同时性转移(确诊时即存在),30%为异时性转移(术后随访出现)。 肝脏作为结直肠癌血行转移最主要的靶器官,通过门静脉系统形成转移病灶。 手术切除原发灶及转移灶仍是wei一gen治手段,但80%-90%的肝转移灶初始无法gen治性切除。
近日,北京大学人民医院胃肠外科申占龙教授、叶颖江教授和中国ke学院生物物理研究所李岩教授合作,在国际quan威期刊Advanced Science发表研究论文N-glycosylation modification of CTSD affects liver Metastases in colorectal cancer。该研究指出糖蛋白—组织蛋白酶D(CTSD)有望成为结直肠癌肝转移的靶向治疗靶点。

N-糖蛋白质组学实现结直肠肝转移靶点
研究者分析了来自14例结直肠癌肝转移患者的14对配对的原发灶和转移灶癌组织:检测到139个N-糖基化蛋白,185个N-糖基化修饰位点,共计490个完整结构的N-糖肽和71个糖基。差异分析发现组织蛋白酶D (CTSD) 263残基上

N-糖基化修饰改变CTSD的折叠位置、稳定性和功能活性
CTSD在CTSD N263Q和CTSD N263Q/N134Q细胞中不能与内体和溶酶体标记共定位(图4B)。也就是说,下调CTSD残基263的N-糖基化修饰水平可能会抑制其向SW480细胞内核内体和溶酶体的转运。与CTSD WT细胞相比,部分缺失N-糖基化修饰的CTSD N263Q细胞的CTSD分泌量减少,而缺失N-糖基化修饰的CTSD N263Q/N134Q细胞的CTSD分泌量增加。因此,由于CTSD残基263的N-糖基化修饰缺失,CRC细胞不能分泌CTSD。
此外,与CTSD WT细胞相比,环己酰亚胺处理3 h后,CTSD N263Q细胞中CTSD的数量明显减少,说明CTSD在263残基处的N-糖基化修饰影响了其稳定性。CTSD N263Q细胞和CTSD N263Q/N134Q细胞的CTSD荧光值低于CTSD WT细胞(图4E)。具体来说,降低CTSD残基134和263的N-糖基化修饰水平可能会降低其蛋白酶活性。综上所述,CTSD残基134和263的N-糖基化修饰可能会改变其折叠位置、稳定性和功能活性。

糖基化修饰的CTSD下游蛋白质筛选和鉴定
CTSD野生型细胞和CTSD N263Q细胞进行了比较蛋白质组分析。研究人员鉴定出在CTSD野生型细胞和CTSD N263Q细胞之间有差异表达的蛋白质共391个。鉴于CTSD的蛋白酶活性,研究人员对仅与CTSD野生型相互作用的蛋白质集和DEPs进行了交集分析。该分析共产生了8个候选分子:ACADM、PRDX3、ALDH2、EHHADH、DHCR7、TGFB1I1、IDH2和ALDH1A1。

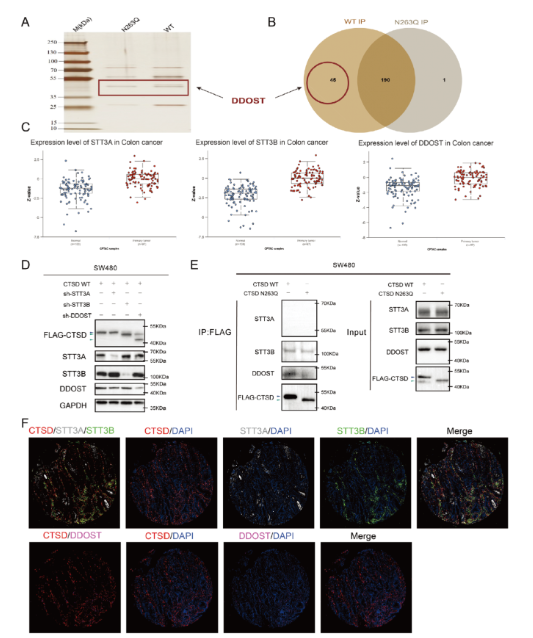
STT3B和DDOST是CTSD的N-糖基转移酶
免疫共沉淀富集与CTSD结合的蛋白,随后通过质谱分析鉴定这些蛋白。分析结果显示,235个蛋白与CTSD WT相互作用,191个蛋白与CTSD N263Q结合。在与CTSD WTwan全相互作用的45个蛋白中,DDOST(也称为OST48)是wei一的N-糖基转移酶,可能参与残基263的N-糖基化修饰。最初的N-糖基转移酶,也被称为寡糖转移酶复合物(OST),由多个蛋白质组成一个复合物。OST以OST-A和OST-B两种形式存在,分别以STT3A和STT3B为催化亚基,分别负责初始N-糖基化。催化亚基能够独立完成N-糖基化加成过程。然而,在某些情况下,需要各种非催化亚基,如DDOST,在此过程中与底物形成稳定的配合物我们利用在线蛋白质组学数据库CPTAC研究了STT3A、STT3B和DDOST在结肠癌组织和配对正常组织中的表达水平,发现这3种蛋白在结肠癌组织中表达上调。靶向敲除STT3A、STT3B和DDOST:当STT3B和DDOST的表达减少时,CTSD的分子量相对于阴性对照显著降低,表明从N-糖基化向非N-糖基化转变。这些发现表明,CTSD残基263的N-糖基化可能受到DDOST的调控,STT3B可能是该位点的催化亚基。
CTSD的N-糖基化修饰调控ACADM/Ferroptosis轴促进CRC进展

研究总结
该研究表明CTSD的N-糖基化修饰显著影响其分泌与活性,进而改变CRC细胞的侵袭/转移能力并影响肝转移形成。CTSD糖基化既可能作为预后/诊断生物标志物,也为阻断结直肠癌肝转移提供了新的分子干预靶点。